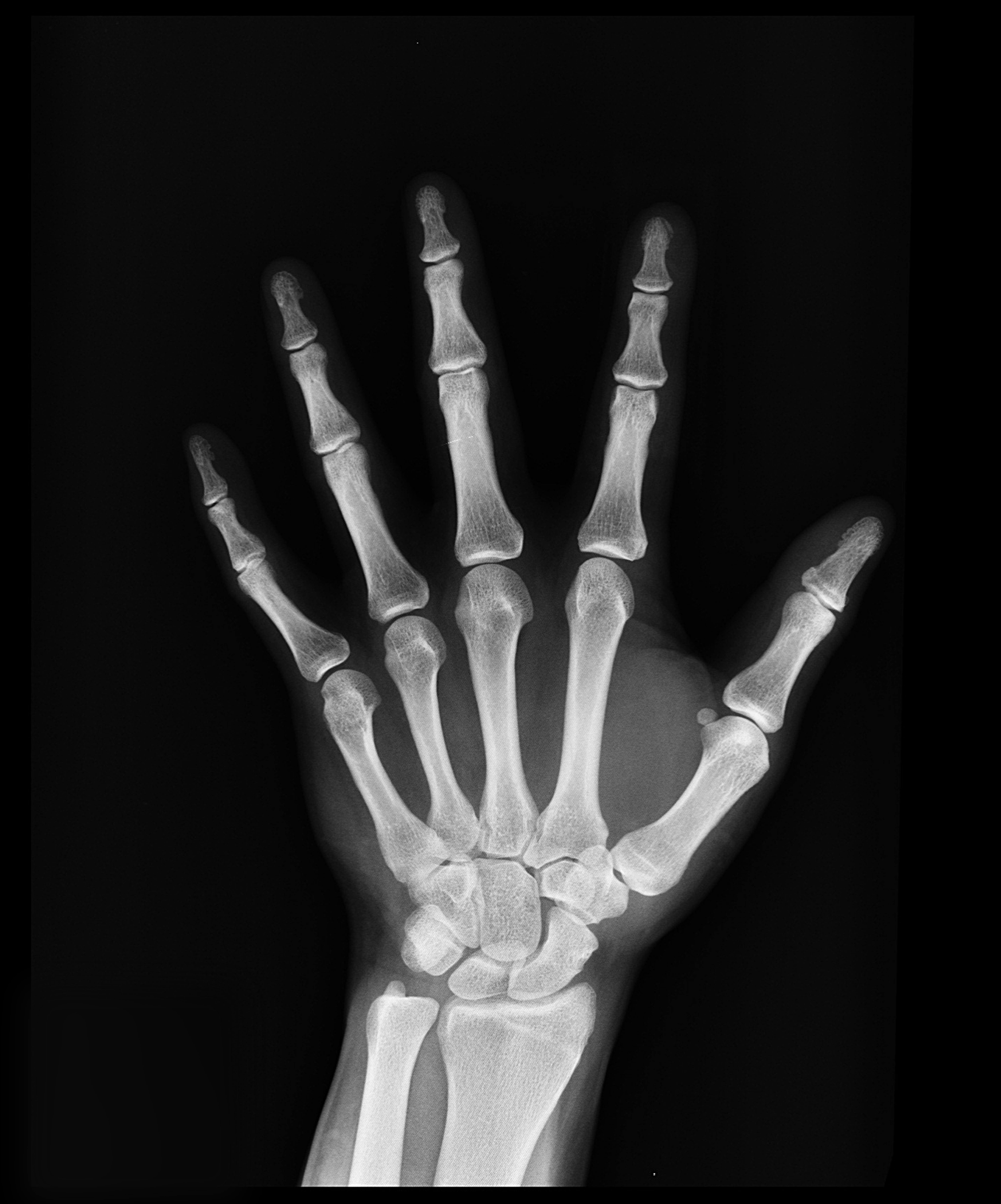
Introduction : Pourquoi l'annotation des images médicales est importante
L'intelligence artificielle révolutionne le diagnostic médical, notamment en radiologie. L'IRM (imagerie par résonance magnétique), la tomodensitométrie (CT) et les rayons X génèrent de riches données visuelles, mais sans annotation précise, l'IA ne peut pas les interpréter avec précision. L'annotation ne se limite pas à dessiner des cases, elle implique une expertise dans le domaine, le contexte clinique et la compréhension de subtilités radiologiques.
Avec la radiologie, les modèles d'IA prennent désormais en charge des cas d'utilisation critiques tels que détection de tumeurs, segmentation des organes, diagnostic des fractures, et dépistage des maladies pulmonaires, des annotations de haute qualité sont plus importantes que jamais.
🧬 Annotations précises = Meilleures prévisions de l'IA = Des résultats plus sûrs pour les patients.
🔑 Concepts clés de l'annotation radiologique
Pour annoter efficacement les données d'imagerie médicale, il est essentiel de comprendre fondements techniques, cliniques et procéduraux qui guident l'annotation en radiologie AI. Ces concepts clés garantissent la cohérence, la qualité et l'interopérabilité entre les équipes, les outils et les pipelines d'IA.
1. Caractéristiques spécifiques à la modalité
Chaque modalité d'imagerie apporte des structures de données et des formats de visualisation uniques qui ont un impact sur la manière dont les annotations doivent être effectuées :
- IRM (imagerie par résonance magnétique): Offre un excellent contraste des tissus mous ; utilisé pour le cerveau, la colonne vertébrale, les articulations et les organes abdominaux. Nécessite une interprétation multi-séquences (par exemple, T1, T2, FLAIR).
- CT (tomographie assistée par ordinateur): Capture des images transversales des os, des tissus mous et des vaisseaux sanguins. Supporte l'annotation de volume 3D sur les tranches axiales.
- Radiographie: Imagerie 2D rapide et économique, généralement utilisée pour les applications osseuses, thoraciques et dentaires. Résolution plus faible mais généralisée dans les services d'urgence et de soins primaires.
Chaque modalité peut également différer en termes de fenêtrage, d'agents de contraste, d'artefacts et de clarté anatomique, facteurs qui influent sur les détails des annotations.
2. Format DICOM et utilisation des métadonnées
Les données radiologiques sont presque toujours stockées dans DICOM (Imagerie numérique et communications en médecine) format. Il ne s'agit pas uniquement de l'image, elle inclut de riches métadonnées telles que :
- Âge, sexe et identification anonymisée du patient
- Heure et lieu du scan
- Type de modalité et paramètres (par exemple, épaisseur de coupe, phase de contraste)
Il est essentiel de comprendre les métadonnées DICOM pour :
- Études correspondantes dans le temps (par exemple, analyses de suivi)
- Éviter les images dupliquées ou corrompues
- Filtrer les données selon des critères démographiques ou pathologiques
Les outils qui permettent d'annoter directement sur les visualiseurs DICOM (comme OHIF ou 3D Slicer) rationalisent le processus.
3. Niveaux de granularité des annotations
Les annotations peuvent être effectuées à différents niveaux, en fonction de la tâche et des résultats attendus de l'IA :
- Labels mondiaux (p. ex. pneumonie : oui/non)
- Boîtes de délimitation (par exemple, localisation suspectée de la lésion)
- Polygones ou masques (par exemple, segmentation d'une tumeur)
- Points clés ou points de repère (par exemple, coins des vertèbres, centres des organes)
- Annotations volumétriques ou à tranches multiples (par exemple, tumeurs cérébrales 3D)
Il est essentiel de choisir la bonne granularité pour former des modèles d'IA à la fois performants et interprétables cliniquement.
4. Annotation 3D dans l'imagerie multitranches
L'IRM et la tomodensitométrie sont de nature volumétrique : chaque scan consiste en un pile de tranches 2D former une vue 3D. Les annotateurs doivent :
- Maintenir la continuité de la forme et de la structure entre les tranches
- Étiqueter les organes et les anomalies comme volumes, pas d'images déconnectées
- Utilisez un logiciel qui prend en charge simultanément les vues axiale, sagittale et coronale
Le fait de ne pas en tenir compte entraîne de mauvaises segmentations volumétriques, ce qui réduit la précision du modèle dans les déploiements réels.
5. Accord entre évaluateurs et confiance dans les annotations
Même chez les radiologues, l'interprétation peut varier. Par conséquent, en mesurant accord entre évaluateurs est la clé :
- Utiliser Kappa de Cohen, Kappa de Fleiss, ou Coefficient de dés pour mesurer le chevauchement.
- Mettez en œuvre un score de confiance à plusieurs niveaux (par exemple, 1 = incertain, 3 = confiant).
- Envisagez des mécanismes de consensus : vote à la majorité, révision par un haut responsable ou arbitrage.
Une annotation cohérente n'améliore pas seulement la formation, elle donne également un aperçu de dans quelle mesure c'est certain ou incertain les radiologues eux-mêmes le sont, ce qui pourra ensuite être utilisé dans des systèmes d'IA sensibles aux incertitudes.
6. Contexte clinique et pertinence de l'étiquette
Les annotateurs doivent comprendre pourquoi une étiquette est nécessaire, et pas seulement où. Par exemple :
- En oncologie : le grade ou le stade de la tumeur peuvent affecter les critères d'annotation.
- En cardiologie : l'identification des types de calcification ou de plaque peut dépendre de la phase de contraste.
- En pédiatrie : les stades de croissance peuvent modifier l'aspect anatomique.
Annotations qui ne correspondent pas à objectifs d'interprétation clinique donnent lieu à une IA qui n'a aucun sens sur le plan clinique.
Meilleures pratiques pour annoter l'IRM, la tomodensitométrie et les radiographies
1. ✅ Impliquer des experts du domaine (radiologues et spécialistes)
Les modèles d'IA entraînés sur des données mal annotées présentent de réels risques médicaux. Impliquez toujours radiologues certifiés ou spécialistes dans le pipeline d'annotations :
- Formez des annotateurs non cliniques à l'aide d'exemples de référence.
- Faites appel à des spécialistes pour les annotations complexes (par exemple, tumeurs cérébrales, pneumopathie interstitielle).
- Demandez à plusieurs experts d'examiner les annotations pour les cas à haut risque.
🔗 Découvrez comment la Mayo Clinic intègre les connaissances des radiologues à l'IA
2. 🖼️ Choisissez le bon type d'annotation par cas d'utilisation
Les différentes tâches d'imagerie nécessitent différents types d'annotations :
Cas d'utilisationModalité d'imagerieType d'annotationSegmentation tumorale IRM, CT Segmentation sémantiqueDétection de fractures Radiographie, tomodensitométrie, boîtiers de liaison, tomodensitométrie, identification de l'opacité pulmonaireRadiographie, tomodensitométrie, polygone ou masqueMarquage vertébral, IRM, points clés + étiquetageEstimation de la taille de la lésion/IRM, masque par pixel
Conseil : choisissez des outils qui prennent en charge Visualisation des volumes en 3D pour les annotations basées sur des tranches.
3. 📚 Utiliser des taxonomies d'étiquettes normalisées
Évitez les incohérences en vous conformant à des taxonomies normalisées :
- Utiliser RadLex (Lexique de radiologie) ou CHAT ASNOMÉ pour un étiquetage uniforme.
- Créez des directives internes pour la hiérarchie de vos étiquettes, en particulier si vous combinez plusieurs ensembles de données.
- Maintenez un dictionnaire de cartes d'étiquettes avec des définitions et des exemples.
4. ⚙️ Sélectionnez des outils conçus pour l'imagerie médicale
Les outils d'annotation à usage général sont souvent insuffisants en radiologie. Priorisez les plateformes qui :
- soutien DICOM gestion des formats et des métadonnées.
- Autorisez la navigation tranche par tranche (en particulier pour la tomodensitométrie et l'IRM).
- Prévoyez un fenêtre/un nivellement pour le réglage du contraste.
- Activez l'étiquetage 3D des volumes et les suggestions de segmentation automatique.
Outils recommandés :
5. 🧪 Intégrez des ensembles de données de référence
Commencez par ensembles de données validés par des experts pour évaluer la précision de vos annotations :
- Utilisez des ensembles de données publics tels que Défi de détection de la pneumonie RSNA (radiographie) ou GOSSES (Segmentation des tumeurs cérébrales par IRM).
- Validez les nouvelles équipes d'annotation par rapport à des références de référence de référence.
- Vérifiez régulièrement les annotations pour détecter toute dérive des étiquettes.
🔗 Accédez aux ensembles de données BRAT pour la segmentation des tumeurs cérébrales
6. 🔁 Créez des boucles de rétroaction itératives
L'annotation est rarement parfaite la première fois. Créez des cycles de feedback entre :
- Annotateurs
- Radiologues
- Ingénieurs ML
Comment ?
- Utilisez un Une liste de contrôle pour chaque lot.
- Visualisez le désaccord entre les annotations.
- Passez en revue les performances du modèle sur les données annotées pour affiner les directives.
7. 🛡️ Garantir la confidentialité et la conformité des données
Travailler avec de vrais scans médicaux, c'est gérer données permettant d'identifier le patient.
- Utilisez des données DICOM anonymisées dans la mesure du possible.
- Suivez HIPAA (États-Unis) ou GDPR (UE) exigences strictes.
- Lignage des données des documents : qui a annoté quoi, quand et comment.
8. 🌍 Garantir la diversité des ensembles de données
Un modèle d'IA formé uniquement à un groupe démographique ou à un type d'appareil ne sera pas généralisé.
- Équilibrez les données selon l'âge, le sexe, l'origine ethnique et les stades de la maladie.
- Utilisez des scans provenant de différents hôpitaux, fabricants et machines (par exemple, GE, Siemens, Philips).
- Suivez les artefacts d'imagerie ou les variations de bruit.
Diversité = Robustesse. Un biais dans la formation entraîne un biais dans le diagnostic.
9. 🔍 Optimiser en fonction de la pertinence clinique
Chaque annotation doit plan d'une décision en matière de diagnostic ou de traitement:
- Pour les tumeurs, définissez la marge, le type et la taille.
- Pour les nodules pulmonaires, faites la distinction entre bénins et suspects.
- Inclure les résultats secondaires dans la mesure du possible (par exemple, accumulation de liquide, calcification).
Utilisez des systèmes de notation clinique tels que BI-RADS (imagerie mammaire) ou Routes pulmonaires le cas échéant.
10. 🔬 Tirez parti des pré-annotations et de l'assistance de l'IA
Accélérez les flux de travail grâce à des outils semi-automatisés :
- Utilisez des modèles d'IA pour pré-segmenter les tumeurs ou les organes.
- Laissez les annotateurs affiner leurs suggestions au lieu de partir de zéro.
- Appliquez l'apprentissage actif : demandez aux modèles de faire ressortir des prévisions incertaines pour les examiner.
⚡ Des outils tels que Étiquette MONAI soutenez les flux de travail d'étiquetage interactifs grâce à l'intégration du deep learning.
11. 📏 Établissez des mesures d'assurance qualité claires
Définissez ce que signifie la qualité pour votre projet d'annotation :
- Coefficient de dés et Ou pour la précision de la segmentation
- Accord entre annotateurs (par exemple, le kappa de Cohen)
- Nombre de corrections pour 100 cas
Communiquez régulièrement les indicateurs d'assurance qualité pour améliorer la transparence et la responsabilité.
12. 🧩 Supporte les entrées multimodalité et multi-séries
En radiologie, les décisions reposent souvent sur plusieurs vues d'imagerie:
- Pour tomodensitométrie, plans axial + sagittal + coronal
- Pour les séries MRI, T1, T2 et FLAIR
- Pour les radiographies, vue latérale et frontale
Les outils doivent permettre de synchroniser les annotations entre les vues ou les séries pour des raisons de cohérence.
13. 👥 Gérez intelligemment le personnel d'annotation
Les pipelines d'annotation nécessitent une coordination :
- Attribuer des tâches en fonction de la spécialité (par exemple, radiologie neuro ou thoracique)
- Utiliser le contrôle de version pour les modifications et les corrections
- Surveillez la productivité sans compromettre la qualité
Envisagez d'externaliser les annotations répétitives à des équipes formées, tout en conservant les annotations sensibles/complexes en interne.
14. 🛠️ Conservez une directive d'annotation vivante
Ne considérez pas les instructions d'annotation comme des PDF statiques. Au lieu de cela :
- Hébergez des documents évolutifs (par exemple, Notion, Confluence) avec des exemples.
- Mettez à jour après chaque cycle d'évaluation de l'assurance qualité.
- Intégrez des captures d'écran et des cas pratiques pour clarifier l'ambiguïté.
🚀 Pièges courants à éviter
- Étiquettes trop généralisées — par exemple, étiqueter « tumeur » au lieu d'en spécifier le type.
- Ignorer la continuité des tranches — Des masques 2D qui ne s'alignent pas sur les tranches de tomodensitométrie et d'IRM.
- Résolution inadéquate — le sous-échantillonnage est trop important pour une annotation plus rapide.
- Aucune étape QA — le fait de ne pas valider entraîne la propagation de l'erreur.
- Ensembles de données déséquilibrés — ne pas couvrir des pathologies ou des données démographiques rares.
🧭 Cas d'utilisation réels et tendances émergentes
À mesure que l'IA en radiologie évolue, les pratiques d'annotation s'adaptent pour répondre nouvelles frontières diagnostiques et capacités technologiques émergentes. Explorons les cas d'utilisation et les tendances les plus marquants qui façonnent l'avenir de l'annotation radiologique.
🧠 1. Segmentation des tumeurs cérébrales à l'IRM (gliomes, métastases, etc.)
Les IRM cérébrales font partie des ensembles de données les plus gourmands en annotations en raison de morphologie complexe des tumeurs et la nécessité de identification précise des limites. Les cas d'utilisation incluent :
- Planification préchirurgicale pour la résection du glioblastome
- Surveillance post-traitement pour la récidive tumorale
- Différenciation entre tumeur et œdème par IRM multiséquences (T1/T2/FLAIR)
Le Défi BRATs a conduit à des modèles de segmentation avancés, mais ces modèles ne fonctionnent bien que lorsqu'ils sont entraînés sur annotations volumétriques 3D précises.
2. Détection de l'infection pulmonaire à la COVID-19 par radiographie pulmonaire et tomodensitométrie
Pendant la pandémie, l'imagerie médicale est devenue outil de triage rapide pour détecter :
- Opacités du verre dépoli
- Consolidations pulmonaires
- Marquages interstitiels
Ces résultats ont dû être rapidement annotés pour les modèles d'IA, ce qui a conduit à la publication d'ensembles de données publics tels que COVID X et Base de données SIRM COVID.
Des modèles de triage pilotés par l'IA et entraînés à partir de radiographies annotées ont aidé les hôpitaux débordés prioriser les soins intensifs.
🦴 3. Interprétation des rayons X de l'appareil locomoteur (fractures, arthrite, espace articulaire)
L'interprétation aux rayons X est souvent effectuée dans des environnements à haute pression tels que salles d'urgence, et l'annotation est essentielle pour les applications d'IA qui prennent en charge :
- Détection de fractures (par exemple, hanche, poignet, épaule)
- Classement de l'arthrose
- Planification du remplacement des articulations
Les stratégies d'annotation incluent :
- Marquage de repères anatomiques pour les angles des articulations
- Tracer des lignes de fracture ou ombrer les perturbations de l'os cortical
- Classification de la gravité en fonction d'Scale AIs visuelles (par exemple, Kellgren—Lawrence)
Des projets tels que MURA (ensemble de données sur les radiographies musculosquelettiques de Stanford) fournissent des images en libre accès mais ne disposent toujours pas d'étiquettes structurées de haute qualité, ce qui met en évidence les problèmes d'annotation persistants.
🧬 4. Planification du traitement oncologique grâce à la radiomique
L'IA est désormais utilisée non seulement pour détecter les lésions, mais aussi pour quantifier leur texture et leur comportement biologique via la radiomique. Cela nécessite des annotations extrêmement précises pour :
- Bordures tumorales
- Descripteurs de formes
- Cartographie de l'hétérogénéité (par exemple, modèles d'intensité des pixels)
Par exemple, dans cancer du poumon traitement, les caractéristiques radiomiques dérivées de tomodensitomiques bien annotées peuvent aider à prédire :
- Réponse à la chimiothérapie
- Probabilité de métastase
- Pronostic global
📘 Pour en savoir plus : La radiomique en oncologie de précision
👶 5. Imagerie pédiatrique avec variabilité développementale
L'annotation des tomodensitogrammes ou des IRM pédiatriques est particulièrement difficile :
- La structure des os et des organes change rapidement avec l'âge
- Les pathologies peuvent se présenter différemment de celles des adultes
- L'exposition des enfants aux rayonnements rend les données plus rares
Des protocoles d'annotation spéciaux sont nécessaires pour :
- Malformations congénitales
- Retards de développement
- Syndromes génétiques rares
Les modèles d'IA entraînés à partir d'ensembles de données pour adultes sont souvent moins performants dans les cas pédiatriques, ce qui souligne encore la nécessité de annotations spécifiques à l'âge.
🦠 6. Segmentation de plusieurs organes en tomodensitométrie abdominale pour les assistants généraux en IA
La tendance à la hausse est modèles de fondation pour la radiologie : grands modèles entraînés à identifier de multiples organes, pathologies et repères. Des projets tels que Segmentateur total ou Projet MONAI visent à créer des modèles universels en tirant parti de :
- Ensembles de données multi-organes annotés de manière cohérente
- Segmentation 3D au niveau des voxels
- Standardisation interhospitalière
Ces cas d'utilisation nécessitent des pipelines d'annotation larges et transversaux qui combinent automatisation, assurance qualité axée sur l'humain et apprentissage fédéré.
🌐 7. Télémédecine et triage par IA dans les environnements à faibles ressources
Dans les régions rurales ou mal desservies, l'IA peut agir comme assistant de diagnostic de premier passage. Mais pour être efficaces, les modèles doivent être entraînés sur des données qui reflètent :
- Prévalence locale de la maladie (p. ex. tuberculose, complications liées à la dengue)
- Appareils d'imagerie portables ou à basse résolution
- Qualité d'image et formats variables
Des projets d'annotation sur la santé mondiale tels que Ensemble de données sur la tuberculose de la Société de radiologie d'Afrique du Sud travaillent à pratiques d'annotation tenant compte de l'équité.
🔗 Découvrez la radiomique et son rôle dans le diagnostic basé sur l'IA
🔚 Conclusion : la qualité des annotations définit la précision du diagnostic
La formation à l'IA en radiologie n'est pas une question de quantité, mais une question précision, consistance, et compréhension clinique. L'application de ces bonnes pratiques aidera votre équipe à :
- Réduire le biais du modèle
- Améliorer l'applicabilité clinique
- Minimiser les erreurs d'annotation
- Accélérez le déploiement des modèles
Qu'il s'agisse d'étiqueter des milliers de radiographies pulmonaires ou de segmenter des tumeurs cérébrales complexes, la qualité des annotations est la pierre angulaire d'une IA fiable en radiologie.
📣 Appel à l'action : créez votre ensemble de données radiologiques avec DataVLab
Vous avez besoin d'aide pour créer des ensembles de données radiologiques de haute qualité ? Chez DataVLab, nous associons notre expertise médicale à des flux de travail d'annotation robustes conçus pour Modèles d'IA par IRM, tomodensitométrie et rayons X. De la gestion DICOM à l'assurance qualité de référence, nous couvrons votre pipeline d'imagerie médicale.
👉 Contactez nos experts en IA médicale dès aujourd'hui et construisons ensemble des modèles de santé plus sûrs et plus intelligents.